
�}Ŀ�б�(�����𰸺ͽ���)
| ||
| ||
| ��{܇ | 20mg/100mL��ѪҺ�еľƾ�������80mg/100mL |
| �����{܇ | ѪҺ�еľƾ�������80mg/100mL |

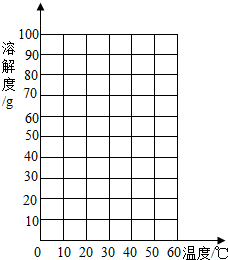
| �ض�/�bC | 0 | 20 | 40 | 60 | |
| �ܽ��/g | A���| | 30 | 35 | 41 | 50 |
| B���| | 25 | 35 | 55 | 90 | |

| �ض�/�bC | 0 | 20 | 40 | 60 | |
| �ܽ��/g | A���| | 30 | 35 | 41 | 50 |
| B���| | 25 | 35 | 55 | 90 | |


����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^ | ����p�_�e�^ | ��vʷ̓�o���x�к���Ϣ�e�^ | �����֙��e�^
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com