
題目列表(包括答案和解析)
| 鹵族元素的名稱 | 氟 | 氯 | 溴 | 碘 |
| 原子序數 | 9 | 17 | 35 | 53 |
| 通常狀況下的狀態 | 氣體 | 液體 | 固體 | |
| 單質的顏色 | 淡黃綠色 | 黃綠色 | 深紅棕色 | 紫黑色 |
| 單質的熔點(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 單質的沸點(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
| 鹵族元素的名稱 | 氟 | 氯 | 溴 | 碘 |
| 原子序數 | 9 | 17 | 35 | 53 |
| 通常狀況下的狀態 | 氣體 | 液體 | 固體 | |
| 單質的顏色 | 淡黃綠色 | 黃綠色 | 深紅棕色 | 紫黑色 |
| 單質的熔點(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 單質的沸點(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
| 鹵族元素的名稱 | 氟 | 氯 | 溴 | 碘 |
| 原子序數 | 9 | 17 | 35 | 53 |
| 通常狀況下的狀態 | 氣體 | 液體 | 固體 | |
| 單質的顏色 | 淡黃綠色 | 黃綠色 | 深紅棕色 | 紫黑色 |
| 單質的熔點(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 單質的沸點(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
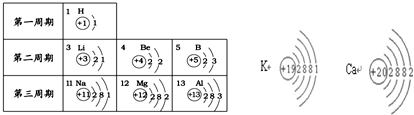
| 第一周期 | 1 H |
||
| 第二周期 | 3 Li |
4 Be |
5 B |
| 第三周期 | 11 Na |
12 Mg |
13 Al |

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com