
題目列表(包括答案和解析)
A.晶體的自范性指的是在適宜條件下晶體能夠自發地呈現封閉規則的多面體幾何外形
B.晶體的各向異性和對稱性是矛盾的
C.晶體的對稱性是微觀粒子按一定規律做周期性重復排列的必然結果
D.晶體的各向異性直接取決于微觀粒子的排列具有特定的方向性
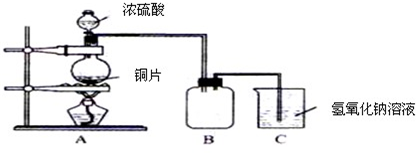
| ||
| ||
 N2+2CO2 將有害的污染物轉化為可參與大氣循環的N2和CO2.
N2+2CO2 將有害的污染物轉化為可參與大氣循環的N2和CO2.| 時間/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com