
�}Ŀ�б�(�����𰸺ͽ���)


| ������ | �� | �� | �� |
| ��Ԫ��ԭ�ӂ����� | n��A����n��C��=2��1 | n��A����n��C��=1��1 | n��B����n��A��=1��4 |
| ������ | �� | �� | �� |
| ��Ԫ��ԭ�ӂ����� | n��D����n��B����n��C��=2��1��3 | n��E����n��F��=1��3 | n��B����n��F��=1��4 |
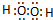
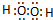


����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^ | ����p�_�e�^ | ��vʷ̓�o���x�к���Ϣ�e�^ | �����֙��e�^
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com