
�}Ŀ�б�(�����𰸺ͽ���)
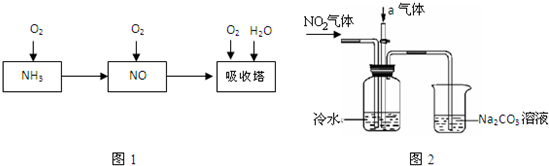
| ||
| �� |
| ||
| �� |
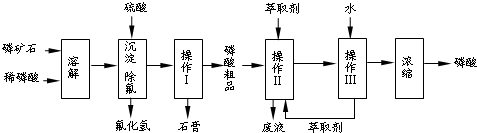
| 1 |
| 2 |
| 1 |
| 2 |
| ���� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mg��OH��2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| �ض� | 10�� | 30�� | 40�� | 50�� | 60�� |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

| �ض�/�� �ܽ��/g �} |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ��NH4��2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| ��NH4��SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
| ��ʼ�F���|��m1/g | �������F���|��m2/g | Ī���}���|�� | �a�� | |
| ��Փ�a��/g | ���H�a��m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^ | ����p�_�e�^ | ��vʷ̓�o���x�к���Ϣ�e�^ | �����֙��e�^
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com