
�}Ŀ�б�(�����𰸺ͽ���)
| ||
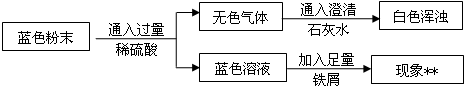
| ||
| ||
| ||
| ||
| ||
| ||
| B | C | D | E | F | |
| ����ǰ | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| ������ | 116.0g | 253.6g | 304.2g | 350.2g | 360.0g |
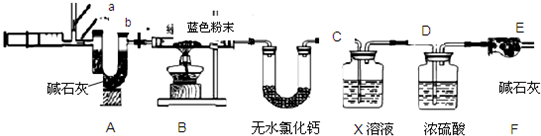
| ||
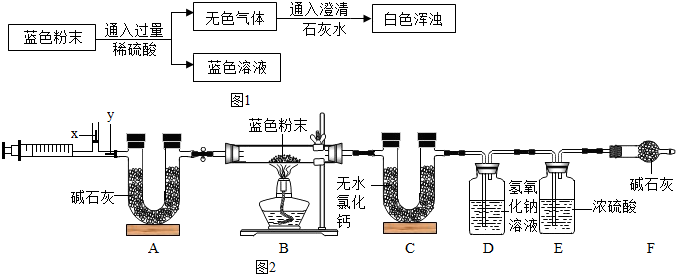
| B | C | D | E | F | |
| ����ǰ | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| ������ | 116.0g | 253.6g | 304.3g | 350.1g | 360.0g |
| ||
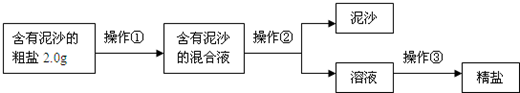
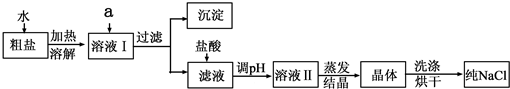
| ��ַ��� |
| ||
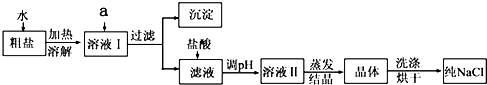
| ��ַ��� |
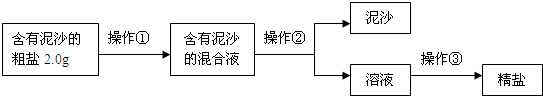
| ���� | ���F�� | ���YՓ |
ԭ��Һ�dz���ʯ��ˮ |
����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^ | ����p�_�e�^ | ��vʷ̓�o���x�к���Ϣ�e�^ | �����֙��e�^
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com